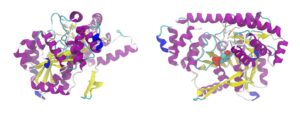
たんぱく質の機能に重要なのは立体構造です。たんぱく質が特有の立体構造をとる原因は、ペプチド結合の主鎖や側鎖間の非共有結合による安定化です。
立体構造は、たんぱく質のアミノ酸配列により自然に決まります。立体構造ができると配列上では離れた残基が近づき、溶媒の極性なども関与して特定分子に対する結合能、触媒能、そのほかたんぱく質分子それぞれの機能が現れます。
たんぱく質は球状のものが多く、球状内部はアミノ酸残基でぎっしり詰まっています。内部空間の75%はアミノ酸残基で満たされ、残る25%は水分子も入れない細かい隙間に分かれています。
アミノ酸側鎖は非極性なものが多く、たんぱく質の内部は大体非極性です。極性アミノ酸残基は分子の表面に出ています。極性残基が分子内部にあれば、機能上何か必要なことが多くなります。逆に非極性残基が分子表面に出ていれば、脂質との結合に関与する可能性が大きくなります。
たんぱく質の機能
たんぱく質の機能は、結合、触媒、伝達、輸送、収縮、栄養、構造です。しかもそのひとつに限りません。
細胞内で進行するさまざまな体に必要な反応は、すべての細胞が生きる温度、pHなど狭い範囲内で進行させなければなりません。そこで触媒が必要になりますが、そのほとんどは酵素、すなわちたんぱく質です。酵素はその対象に結合し、共有結合や非共有結合を切ったりつくったりする化学変化を起こします。酵素がないと代謝は進みません。
細胞膜の物質の透過を助けるたんぱく質もあります。物質が濃い方から薄い方へ移動する受動輸送だけでなく、薄い方から濃い方へ移るには能動輸送、すなわちエネルギーを必要とします。エネルギーを消費して結合を生じ、神経の伝達が行われます。
収縮は、筋肉の特性です。筋肉の主体はたんぱく質で、収縮は分子がお互いにずれ動くことです。ある種のたんぱく質は、その収縮により運動と体のバランスに関与します。
植物の種子には貯蔵たんぱく質があり、光合成が始まるまでの窒素源、エネルギー源となります。穀物の主要な貯蔵たんぱく質プロラミンは、人や家畜が消費するたんぱく質の相当の部分を占めます。
皮膚や骨の繊維状たんぱく質であるコラーゲンは、構造たんぱく質です。
このようにたんぱく質は、あらゆる面で細胞活性に関わっています。
たんぱく質の第一構造
たんぱく質は、アミノ酸同士がペプチド結合でつながった直鎖状の分子です。ペプチド結合とは、ひとつのアミノ酸のアミノ基ともうひとつのアミノ酸のカルボキシル基からH⁺とOH⁻がとれ、脱水縮合したものです。
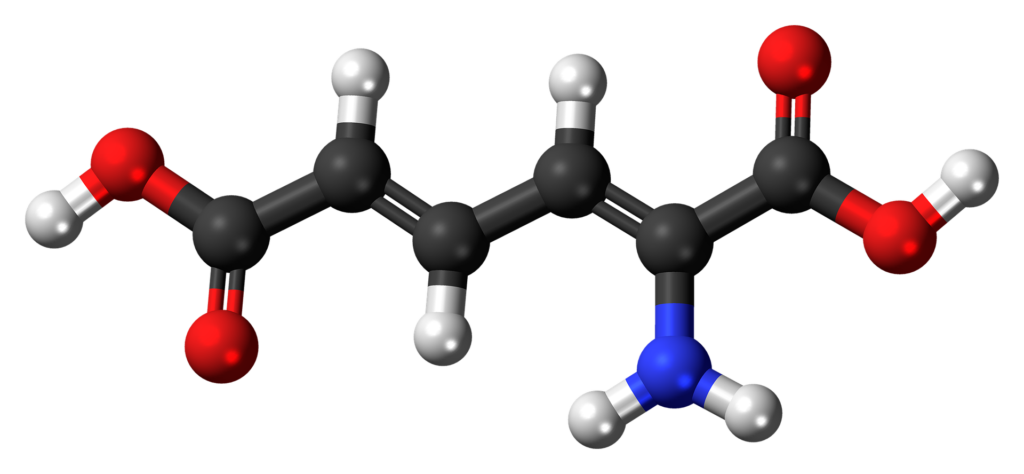
たんぱく質のポリペプチド構造、すなわち鎖状構造はいくらでも長くなることができるため、たんぱく質の分子量に制限はありません。分子量は数千~数百万まであります。たんぱく質中に取り込まれたアミノ酸は、脱水された形で、アミノ酸残基と呼びます。
20種のアミノ酸残基がたんぱく質の構造の大部分を占めています。イミノ酸であるプロリンを除き、すべてがα-アミノ酸で側鎖(R基)だけが異なります。イミノ酸は、分子中にイミノ基(>C=NH)とカルボキシル基(-COOH)を両方持ちます。 α-アミノ酸は、カルボキシル基が結合している炭素(α炭素)にアミノ基も結合しているアミノ酸でありRCH(NH2)COOH という構造を持っています。
たんぱく質の第一構造はアミノ酸の並び方です。非極性すなわち疎水性のR基を持つアミノ酸は、アラニン(Ala)、バリン(Val)、ロイシン(Leu)、イソロイシン(Ile)、メチオニン(Met)、フェニルアラニン(Phe)、トリプトファン(Trp)です。極性だが電荷のないアミノ酸は、グリシン(Gly)、セリン(Ser)、トレオニン(Thr)、システイン(Cys)、チロシン(Tyr)、アスパラギン(Asn)、グルタミン(Gln)です。正電荷を持つR基を有するアミノ酸は、リシン(Lys)、アルギニン(Arg)、ヒスチジン(His)です。負電荷を持つR基を有するアミノ酸は、アスパラギン酸(Asp)、グルタミン酸(Glu)です。プロリン(Pro)を含め、20種のアミノ酸が地球上の全生物のたんぱく質を構成しており、生物界はこの点において、画一的です。この20種のアミノ酸の並び方で、ポリペプチド鎖の反応性、折れ曲がり方が決まります。
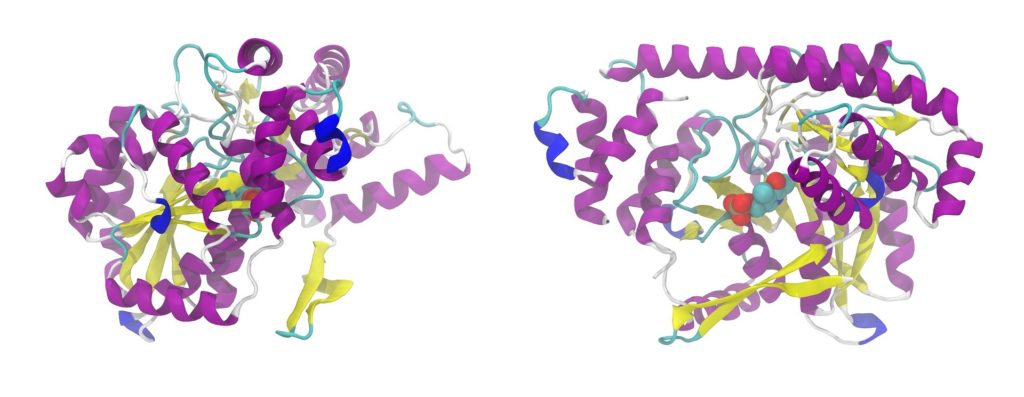
たんぱく質の立体構造
たんぱく質の機能に重要なのは立体構造です。たんぱく質が特有の立体構造をとる原因は、ペプチド結合の主鎖や側鎖間の非共有結合による安定化です。
立体構造は、たんぱく質のアミノ酸配列により自然に決まります。立体構造ができると配列上では離れた残基が近づき、溶媒の極性なども関与して特定分子に対する結合能、触媒能、そのほかたんぱく質分子それぞれの機能が現れます。
たんぱく質は球状のものが多く、球状内部はアミノ酸残基でぎっしり詰まっています。内部空間の75%はアミノ酸残基で満たされ、残る25%は水分子も入れない細かい隙間に分かれています。
アミノ酸側鎖は非極性なものが多く、たんぱく質の内部は大体非極性です。極性アミノ酸残基は分子の表面に出ています。極性残基が分子内部にあれば、機能上何か必要なことが多くなります。逆に非極性残基が分子表面に出ていれば、脂質との結合に関与する可能性が大きくなります。
球状でないたんぱく質もあります。繊維状たんぱく質で、皮膚、軟骨、骨などに存在するコラーゲンは、哺乳類では最も多く、体重の6%、全たんぱく質の3分の1を占めます。コラーゲンは、グリシン、プロリン、ヒドロキシプロリン、アラニン含量が高くなります。コラーゲンは、3本鎖がらせん状によじれ、互いに結合した構造です。毛、くちばし、爪、鱗、角、ひづめ、羊毛などの主成分ケラチンも繊維状たんぱく質です。絹や筋肉を構成するトロポミオシンなどの収縮たんぱく質も繊維状です。
球状でも繊維状でもないたんぱく質もあります。
たんぱく質のような複雑な巨大分子の構造は、アミノ酸配列による第一構造、ポリペプチド鎖上での近い部分の折れ曲がり方を示す第二構造、比較的離れたアミノ酸残基同士の相互作用などでつくられる第三構造、他のたんぱく質と会合して多量体たんぱく質やオリゴマーたんぱく質を形成する第四構造があります。
まとめ
たんぱく質の機能は、結合、触媒、伝達、輸送、収縮、栄養、構造です。細胞内で進行するさまざまな体に必要な反応の触媒は、ほとんど酵素、すなわちたんぱく質です。酵素がないと代謝は進みません。細胞膜の物質の透過を助けるたんぱく質もあります。筋肉の主体はたんぱく質で、収縮は分子がお互いにずれ動くことです。植物の種子には貯蔵たんぱく質があり、光合成が始まるまでの窒素源、エネルギー源となります。皮膚や骨の繊維状たんぱく質であるコラーゲンは、構造たんぱく質です。このようにたんぱく質は、あらゆる面で細胞活性に関わっています。
たんぱく質は、アミノ酸同士がペプチド結合でつながった直鎖状の分子です。ペプチド結合とは、ひとつのアミノ酸のアミノ基ともうひとつのアミノ酸のカルボキシル基からH⁺とOH⁻がとれ、脱水縮合したものです。たんぱく質のポリペプチド構造、すなわち鎖状構造はいくらでも長くなることができるため、たんぱく質の分子量に制限はありません。分子量は数千~数百万まであります。たんぱく質の第一構造はアミノ酸の並び方です。イミノ酸のプロリンを含め、20種のアミノ酸が地球上の全生物のたんぱく質を構成しています。
たんぱく質の機能に重要なのは立体構造です。たんぱく質が特有の立体構造をとる原因は、ペプチド結合の主鎖や側鎖間の非共有結合による安定化です。立体構造は、たんぱく質のアミノ酸配列により自然に決まります。立体構造ができると配列上では離れた残基が近づき、溶媒の極性なども関与して特定分子に対する結合能、触媒能、そのほかたんぱく質分子それぞれの機能が現れます。